Kontakt
Impressum
Wenn es kühl wird, rücken wir zusammen - oder etwa doch nicht?
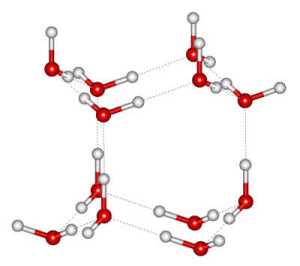
Wir hatten ja gesehen, dass man Molekülpaare und größere Ansammlungen dadurch begünstigen kann, dass man die Temperatur erniedrigt. Die meisten Substanzen schrumpfen etwas, wenn man sie abkühlt. Das liegt daran, dass die zwischenmolekularen Wechselwirkungen sich bei tiefer Temperatur stärker auswirken können - man rückt zusammen. Auch Wasser tut das, aber nur etwa bis 4 Grad Celsius. Darunter dehnt es sich wieder aus. Und wenn es gefriert, macht sein Volumen einen regelrechten Sprung nach oben. Woran liegt das? Ein Wassermolekül kann zweimal als Donor, zweimal als Akzeptor für Wassserstoffbrücken dienen.
In warmem Wasser schaffen es die Moleküle nicht, all diese Möglichkeiten zu verwirklichen, aber das gelingt mit zunehmender Abkühlung immer besser. Dabei entsteht ein relativ offenes Netzwerk, da Wasserstoffbrücken am liebsten schön geradlinig sind. Eis eben. Dieser Prozess beginnt schon vor dem Erstarren, daher dehnt sich Wasser schon unterhalb von 4 Grad aus. Was haben wir davon? Dieser Effekt sorgt z.B. dafür, dass ein Teich von oben zufriert, wir darauf Schlittschuh laufen und die Fische darunter bei 4 Grad trotzdem weiter herumschwimmen können.